龙华出入境电话:常规实验流程
来源:百度文库 编辑:偶看新闻 时间:2024/04/28 17:36:23
1. 细胞总RNA的提取
1、取出培养瓶,沿瓶壁小心倒掉培养基,用冷的PBS清洗2遍。
2、吸弃PBS,对于50 ml培养瓶,每瓶加入0.9 ml RNA裂解液;对于6孔板,则每孔加入0.6 ml RNA裂解液。
3、用1 ml移液器反复吹打40次,直至裂解液中无明显沉淀。
4、将各培养瓶中的裂解液分别收集至1.5 ml EP管中,各管编号。
5、加入0.2 ml氯仿(总体积的1/5,作用为沉淀提取RNA),于涡旋器上振荡15 S,待管内液体充分乳化为乳白状后,静置3 min。
6、4 ºC离心15 min,转速为12,000 g。
7、从离心机中取出EP管,此时匀浆液分为三层:无色的上清液(含RNA)、中间白色蛋白层及带有颜色的下层有机相。小心吸取上清液转移至另一新的EP管中(切勿吸出白色中间层),各管编号。
8、加入0.5 ml异丙醇(与吸出的上清液等体积,溶解RNA),于涡旋器上充分混匀,静置10 min。
9、4 ºC离心10 min,转速为12,000 g。
10、小心吸弃上清,沿管壁缓慢加入75%的乙醇1 ml(切勿触及沉淀),于涡旋器上充分振荡后,4 ºC离心5 min,转速为7,500 g(g为重力加速度,低速离心时转速用rpm表示,高速离心时转速用g表示)。
11、弃乙醇(在不触及管底沉淀的前提下尽可能吸弃完全),室温干燥沉淀5 min(不能完全干燥),加入25 μl RNase-free 水溶解沉淀。
12、RNA电泳:取3 µl RNA与1µl Loading dye(是跑琼脂糖凝胶用来染DNA的染料,它是和loading buffer按一定的比例混合而成的.有的进口试剂buffer里已经加了loading dye的,就不用加了.试剂说明书都有说明的. marker是直接加到凝胶里的.)充分混匀后,加入琼脂糖凝胶(1%)中,进行电泳分析。28S与18S的相对亮度约为2:1,若比值下降则说明RNA降解。剩余的RNA于-80 ºC冷冻保存。
2. cDNA逆转录分析
1、逆转录分析的实验步骤详见图1。
2、逆转录后所得的cDNA保存于-20 ºC,以待分析。
3、逆转录完毕,取2 µl cDNA与1µl上样缓冲液混匀,进行琼脂糖(1%)电泳分析。如各条带亮度相差过大,说明逆转录失败,则不能进行PCR分析。
3. RT-PCR反应实验
1、PCR操作前,先将cDNA从冰箱取出,于室温下静置5min左右,然后以4,000rpm离心数分钟,再行下述操作。RT-PCR反应体系的组成详见表1。
2、RT-PCR的反应操作均于冰盒中进行。

图1. cDNA逆转录反应操作步骤(注:Oligdt与Rnase free H2O混合后分装至各样品管,一般多配1个样品的量;dNTP、5×buffer与RNA inhibitor混合后分别加至各样品管,亦多配1个样本的量;AMV Rtase需每个样品单加。)95度灭活逆转录酶。

4. 凝胶电泳实验
1、准确称取0.3 g 琼脂糖,加入20 ml TAE电泳缓冲液,加热溶解。
2、加入0.2 μl Godview(其终浓度应为1%),充分混匀。
3、待凝胶液稍冷却后,缓慢倒入凝胶槽中。
4、将凝胶槽置于4 ºC冰箱,待其自行冷却。
5、置凝胶槽于电泳仪中(凝胶需在电泳液的液面以下),加样孔朝向负极。
6、取5 μl PCR扩增产物与1 μl 上样缓冲液:于PE手套上充分混匀后加入各凝胶孔内。
7、电泳。将电流设为150 mA,以使电泳条件为恒压状态,电压设为80 V,电泳时间视实际扩增的产物而定。
8、取出电泳完毕的胶条,进行凝胶成像分析。
Oligdt:随机引物。对于真核生物来说,RNA末端有一段保护用的PolyA序列,也就是一长串AAAAAAAAA的碱基,大概十多个碱基,所以我们会用oligdT引物来逆转录。而原核类的没有PolyA结构,所以用随机引物来跟RNA碱基互补配对,随机引物就是包含了所有碱基组合的引物(如八聚体的随机引物有4的8次方中序列的引物在里面),RNA加热后变成单链的线性状,这时再降低温度退火(0度),引物就跟RNA配对结合了,然后在40多度的环境下由逆转录酶合成与RNA互补的另一条链,这样就得到cDNA了 RNase是RNA酶。RNase-free:无RNA酶。Rnase free H2O:无RNA酶水,即DEPC水。Buffer::缓冲液。缓冲液的目的是给Taq DNA聚合酶提供一个最适酶催反应条件。目前最为常用的缓冲体系为10-50mmol/L Tris-HCl (pH8.3-8.8,20℃) Tris是一种双极性离子缓冲液,20℃时其pKa值为8.3,△pKa值为-0.021/℃。因此,20mmol/l Tris-HCl(pH8.3,20℃)在实际PCR中,pH变化于6.8-7.8之间。改变反应液的缓冲能力,如将Tris浓度加大到50mmol/L,pH8.9,有时会增加产量。
附录2:Westernblot 操作规程
(一)细胞裂解及蛋白样品的定量处理
1、将培养的细胞经预冷的PBS漂洗2次后,用细胞刮刮取贴壁细胞,离心后弃上清。
2、加入适量裂解液(具体体积视所检测的目标蛋白而定),于冰上反复吹打2min(切忌将气泡带入离心管中)。
3、吹打完毕,将裂解产物全部转移至预冷的微量离心管中,置于冰上,每5min振荡一次,共孵育30min,以使其充分裂解。
4、4 ºC离心12,000g,离心时间为15 min。
5、每管各取10 µl上清液,进行蛋白定量(每个样品重复2孔)。
6、将各管上清液全部转移至新预冷的微量离心管中,记录各管的裂解总体积;以蛋白浓度最低的管为标准,用裂解液将其余各管调整至与该管相同的浓度;将各管样品与5×上样缓冲液混合后,于沸水中煮10min,即为蛋白样本;最终的样品于-80 ºC保存。
(二)组织裂解操作方法
1、用灭菌的预冷的工具分离目的组织,尽量置于冰上以防蛋白酶水解。
2、将组织块放在圆底的微量离心管或Eppendorf管中,加入液氮冻结组织于冰上均质研磨。
3、每约5 mg加入约300μl 预冷的裂解液,冰浴匀浆后置于4 ºC摇动2小时,裂解液体积与组织样本量有适当比例,(最终的蛋白浓度至少达到0.1mg/ml, 理想的蛋白浓度应为1-5 mg/ml)。
4、4 ºC离心12,000rpm,20 min,轻轻吸取上清,转移至新预冷的微量离心管中置于冰上,即为蛋白样本,弃沉淀。
(三)Westernblot 操作规程
1、封闭胶槽。灌胶之前,先用胶条封闭胶槽底部,再用5ml注射器将0.5%琼脂糖沿胶槽边沿快速(避免琼脂糖凝固)注入封闭胶槽。
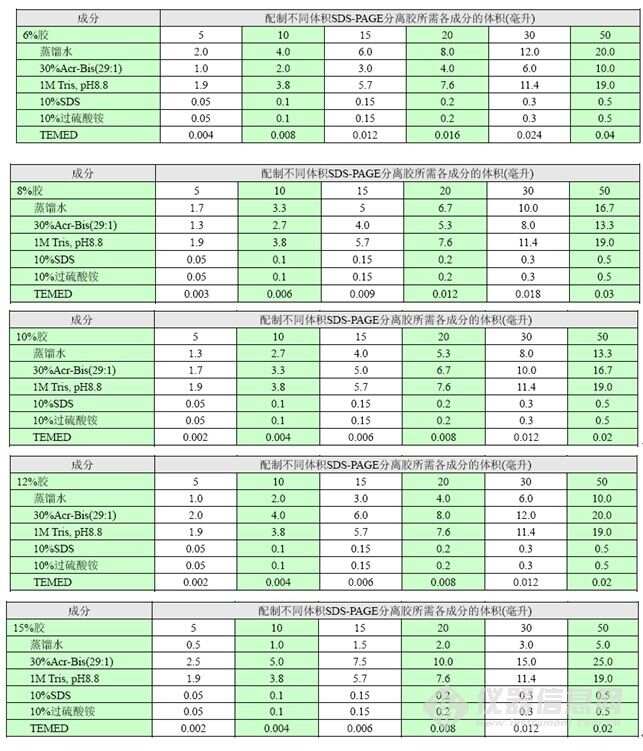
2、配胶。浓缩胶的配制方案详见表1,分离胶的浓度选择详见表2,分离胶的配制方案详见表3。配胶时最后加TEMED。

3、分离胶的灌制。用注射器沿倒胶槽边缘迅速注入分离胶,每块胶按5ml配制即可。分离胶灌制完毕,于其上加入1ml去离子水,以防止胶面氧化。为使电泳槽两侧胶面的电泳速度一致,两侧胶槽内的分离胶及水的体积应保持一致。
3、浓缩胶的灌制。待分离胶凝固后(约50min),倒去胶面上层水,用滤纸吸干。沿胶槽边缘迅速注入浓缩胶,每块胶按4ml配制即可。然后,将梳子沿水平方向轻轻插入,防止气泡进入胶层。
4、蛋白样品准备。取出蛋白样品,于沸水中煮10min。煮好后瞬时离心,并置于37 ºC水浴箱中备用。
5、1×电泳缓冲液配制。去离子水400 ml,5×SDS电泳缓冲液100ml。
6、将浓缩胶放入电泳槽中(若只电泳一块胶,则胶槽另一侧需垫一块玻璃板),将电泳液缓慢注入电泳槽,槽内电泳液需漫过内侧的玻板,外侧需漫过金属线。加液完毕,轻轻拔掉胶条。
7.预电泳。在每块胶上任选择一电泳孔,加入20 μl左右上样缓冲液,在80V电压下进行电泳,直至上样缓冲液全部从分离胶中分离并进入电泳液中。
8、上样。待浓缩胶凝固后上样(约30min)。按照各管样品的总体积,算出其实际上样量(理论上样体积为30µl),加样前先用200µl加样器将样品轻轻混匀,上样速度要慢,否则样品易溢出加样孔。每加一个样品,进样针需用去离子水反复冲洗数次,再用电泳缓冲液润洗数次,以免交叉污染。蛋白Marker的上样量为4µl(不足30 µl时,以1×上样缓冲液补足)。上样完毕,在加样孔的两侧分别注入30µl1×上样缓冲液,以防止边缘效应。进样针用完后,先用去离子水清洗数次,再用甲醇反复冲洗,最后用去离子水清洗晾干后保存。
9、电泳。电泳采用恒压模式,先选择80V电压,待上样缓冲液运动至浓缩胶与分离胶分界线处时,将电压调整至100 V。待胶条中蛋白Marker的各条带彻底分离时,即可终止电泳。
10、切胶。电泳结束,取出胶槽中的玻璃板,根据目的蛋白大小,对比蛋白marker的相应位置,切下所需胶条,同时在靠近正常对照组一侧的左上角切一小块作为标志,然后将胶条置于1×电转液中。
11、电转前的准备:① 电转膜的准备。根据胶条的大小裁剪PVDF膜,并在膜的一角斜切以作为标志,然后将膜置于甲醇中浸泡2min后,迅速转移至电转液中,继续浸泡15 min(PVDF是疏水性的,在转膜缓冲液里很难浸透,甲醇处理后使更容易浸润。用甲醇泡的目的是为了活化PVDF膜上面的正电基团,使它更容易跟带负电的蛋白质结合)。②大蛋白(>100kD)易在凝胶里形成聚集沉淀,故转膜时在电转液中加入终浓度为0.1%的SDS,以避免出现这种情况;甲醇易使SDS从蛋白上脱失,故对大蛋白分子转膜处理时,应将电转液中甲醇的浓度降至10%,以防止蛋白沉淀。
12、滤纸的准备。根据所切胶条的大小裁剪滤纸(3张叠在一起),并将其浸于电转液中备用。所剪滤纸的长及宽均较PVDF膜小2mm,以防短路。
13、转胶。将夹子打开使黒的一面保持水平,其上垫一张海绵垫,用1ml枪头擀走里边的气泡;在海绵垫上垫三层滤纸,亦需擀走气泡;第3层放置胶条(胶条有切口的一侧位于左上角);第4层为膜(膜的切口与胶条的切口相对应),第5层为滤纸;第6层为海绵垫。电转液中含甲醇,操作时需带PE手套。
14、转膜。将夹子放入电转槽中,要使夹的黑面对槽的黑面,夹的白面对槽的红面。电转时会产热,应将电转槽放入盛有冰块的盆中。转膜时间视目标蛋白的分子量而定,恒流转膜(250mA),各目标蛋白的转膜时间如下:Bcl-2(28kD)、Bax(21kD)及Casepase-3(35/17/21kD)转膜时为50min;p38(38kD)、ERK(42/44kD)、SAPK(46/54kD)、β-actin(43kD)、及IκB(41kD)转膜时间为70min;Akt(60/56kD)转膜时间为90min;NF-κB(65kD)转膜时间为120min;PI-3(85kD)、VCAM-1(110kD)及ICAM-1(85-110kD)转膜时间为240min。
亦可进行半干转,条件如下:0.6 mA/cm2(Biorad公司电转仪),转膜时间视蛋白的分子量而定。
15、转膜完毕,回收电转液,将膜置于电转液中漂洗数分钟。
16、PBST配制。250μl Tween20加到500 ml PBS中即可。
17、① 5%脱脂奶粉配制:1.5g奶粉加30 ml PBST。②5%BSA配制:磷酸化蛋白应使用5%BSA封闭,因为脱脂奶粉含有酪蛋白,该蛋白本身就是一种磷酸化蛋白,此时使用脱脂奶粉会结合磷酸化抗体从而易产生高背景。
18、将膜置于5%的脱脂奶粉或BSA中,于摇床上封闭1h。封闭完毕,以PBST漂洗1次。
19、一抗的准备。将一抗贮存液按说明书提供的稀释倍数,用5%脱酯奶粉稀释成应用液。
20、一抗的孵育。一抗孵育可按以下两种方法进行:1)剪一PE指套;将PBST加入PE指套中,检查是否漏液;将膜加入指套中,再加入一抗,膜的正面朝下。2)取一培养皿,培养皿的底预先铺一层石蜡,培养皿的盖预先铺一张浸有去离子水的滤纸;将膜置于培养皿中,正面朝上,将抗体滴于其上(约1ml左右)。将加有一抗的膜在摇床上室温轻摇1 h,冰箱里4ºC封闭过夜。一抗的孵育时间取决于抗体与蛋白的亲和性及蛋白的含量丰度,建议使用较高的抗体稀释倍数和较长的孵育时间来保证特异性结合。尽可能选择低温孵育,如果在封闭液中孵育一抗过夜,应在4ºC进行,否则会产生污染而破坏蛋白(特别是磷酸基团)。
21、取出一抗,以PBST漂洗3次,每次5min。
22、按说明书提供的稀释倍数,用5%脱脂奶粉配制二抗。二抗孵育的滴加步骤亦与一抗相类;将加有二抗的膜室温下于摇床上轻摇1h,振摇时注意正面朝下。
23、取出二抗,以PBST于摇床上漂洗3次,每次5min。
24、化学发光反应。取出ECL发光试剂,吸取等体积的A液和B液配成反应液,充分混匀。将膜从PBST中取出并用滤纸吸干,放入已用石蜡填平的培养皿中,再加入配好的发光反应液,放入图像采集仪内成像,根据图像的亮度调整曝光时间。
附录3:细胞免疫组化操作规程
1、PBS洗细胞3次,每次5min.
2、4%多聚甲醛固定(以PBS溶解,溶解时需加热至60°C,同时加数滴1mol/l的NaOH),时间30min。
3、弃固定液,PBS洗3次,每次5min.
4、0.4%H2O2孵育10min(9.5ml甲醇+0.35 ml H2O2+0.15ml 30%H2O2),以抑制过氧化物酶。
5、弃上清,PBS洗3次,每次5min.
6、0.3%Triton(先配成3%的贮存液,临用时稀释。以PBS溶解,溶解时需加热至37°C),室温孵育25min。
7、弃上清,PBS洗3次,每次5min.
8、羊血清封闭10min.
9、弃血清,加一抗,4°C过夜。
10、次日,37°C 继续孵育1 h后,PBS洗2次,每次5min.
11、加二抗,37°C孵育1 h.
12、PBS洗2次,每次5min.
13、加DAB显色,至背景为浅黄色。
14、弃上清,PBS洗3次,每次5min.
15、苏木精染色5-10min.
16、弃苏木精,水洗数次。
17、饱和碳酸锂染30S.
18、弃碳酸锂,水洗数次。
19、盐酸酒精脱色,过一下即可。
20、弃上清,水洗数次。
21、微风吹干(一定要吹干,否则镜下非常模糊)。
22、梯度酒精透明,75%酒精30S;80%酒精30S;95%酒精1-2min;100%酒精2-3min.
23、二甲苯透明5-10min,充分风干。
24、10%磷酸甘油封片(甘油与PBS按1:9比例配制),镜检。
注:酸酒精:acid alcohol (0.5% concentrated HCl in 70%ethanol/water)
1、取出培养瓶,沿瓶壁小心倒掉培养基,用冷的PBS清洗2遍。
2、吸弃PBS,对于50 ml培养瓶,每瓶加入0.9 ml RNA裂解液;对于6孔板,则每孔加入0.6 ml RNA裂解液。
3、用1 ml移液器反复吹打40次,直至裂解液中无明显沉淀。
4、将各培养瓶中的裂解液分别收集至1.5 ml EP管中,各管编号。
5、加入0.2 ml氯仿(总体积的1/5,作用为沉淀提取RNA),于涡旋器上振荡15 S,待管内液体充分乳化为乳白状后,静置3 min。
6、4 ºC离心15 min,转速为12,000 g。
7、从离心机中取出EP管,此时匀浆液分为三层:无色的上清液(含RNA)、中间白色蛋白层及带有颜色的下层有机相。小心吸取上清液转移至另一新的EP管中(切勿吸出白色中间层),各管编号。
8、加入0.5 ml异丙醇(与吸出的上清液等体积,溶解RNA),于涡旋器上充分混匀,静置10 min。
9、4 ºC离心10 min,转速为12,000 g。
10、小心吸弃上清,沿管壁缓慢加入75%的乙醇1 ml(切勿触及沉淀),于涡旋器上充分振荡后,4 ºC离心5 min,转速为7,500 g(g为重力加速度,低速离心时转速用rpm表示,高速离心时转速用g表示)。
11、弃乙醇(在不触及管底沉淀的前提下尽可能吸弃完全),室温干燥沉淀5 min(不能完全干燥),加入25 μl RNase-free 水溶解沉淀。
12、RNA电泳:取3 µl RNA与1µl Loading dye(是跑琼脂糖凝胶用来染DNA的染料,它是和loading buffer按一定的比例混合而成的.有的进口试剂buffer里已经加了loading dye的,就不用加了.试剂说明书都有说明的. marker是直接加到凝胶里的.)充分混匀后,加入琼脂糖凝胶(1%)中,进行电泳分析。28S与18S的相对亮度约为2:1,若比值下降则说明RNA降解。剩余的RNA于-80 ºC冷冻保存。
2. cDNA逆转录分析
1、逆转录分析的实验步骤详见图1。
2、逆转录后所得的cDNA保存于-20 ºC,以待分析。
3、逆转录完毕,取2 µl cDNA与1µl上样缓冲液混匀,进行琼脂糖(1%)电泳分析。如各条带亮度相差过大,说明逆转录失败,则不能进行PCR分析。
3. RT-PCR反应实验
1、PCR操作前,先将cDNA从冰箱取出,于室温下静置5min左右,然后以4,000rpm离心数分钟,再行下述操作。RT-PCR反应体系的组成详见表1。
2、RT-PCR的反应操作均于冰盒中进行。
图1. cDNA逆转录反应操作步骤(注:Oligdt与Rnase free H2O混合后分装至各样品管,一般多配1个样品的量;dNTP、5×buffer与RNA inhibitor混合后分别加至各样品管,亦多配1个样本的量;AMV Rtase需每个样品单加。)95度灭活逆转录酶。
表1. RT-PCR扩增反应体系组成
4. 凝胶电泳实验
1、准确称取0.3 g 琼脂糖,加入20 ml TAE电泳缓冲液,加热溶解。
2、加入0.2 μl Godview(其终浓度应为1%),充分混匀。
3、待凝胶液稍冷却后,缓慢倒入凝胶槽中。
4、将凝胶槽置于4 ºC冰箱,待其自行冷却。
5、置凝胶槽于电泳仪中(凝胶需在电泳液的液面以下),加样孔朝向负极。
6、取5 μl PCR扩增产物与1 μl 上样缓冲液:于PE手套上充分混匀后加入各凝胶孔内。
7、电泳。将电流设为150 mA,以使电泳条件为恒压状态,电压设为80 V,电泳时间视实际扩增的产物而定。
8、取出电泳完毕的胶条,进行凝胶成像分析。
Oligdt:随机引物。对于真核生物来说,RNA末端有一段保护用的PolyA序列,也就是一长串AAAAAAAAA的碱基,大概十多个碱基,所以我们会用oligdT引物来逆转录。而原核类的没有PolyA结构,所以用随机引物来跟RNA碱基互补配对,随机引物就是包含了所有碱基组合的引物(如八聚体的随机引物有4的8次方中序列的引物在里面),RNA加热后变成单链的线性状,这时再降低温度退火(0度),引物就跟RNA配对结合了,然后在40多度的环境下由逆转录酶合成与RNA互补的另一条链,这样就得到cDNA了 RNase是RNA酶。RNase-free:无RNA酶。Rnase free H2O:无RNA酶水,即DEPC水。Buffer::缓冲液。缓冲液的目的是给Taq DNA聚合酶提供一个最适酶催反应条件。目前最为常用的缓冲体系为10-50mmol/L Tris-HCl (pH8.3-8.8,20℃) Tris是一种双极性离子缓冲液,20℃时其pKa值为8.3,△pKa值为-0.021/℃。因此,20mmol/l Tris-HCl(pH8.3,20℃)在实际PCR中,pH变化于6.8-7.8之间。改变反应液的缓冲能力,如将Tris浓度加大到50mmol/L,pH8.9,有时会增加产量。
附录2:Westernblot 操作规程
(一)细胞裂解及蛋白样品的定量处理
1、将培养的细胞经预冷的PBS漂洗2次后,用细胞刮刮取贴壁细胞,离心后弃上清。
2、加入适量裂解液(具体体积视所检测的目标蛋白而定),于冰上反复吹打2min(切忌将气泡带入离心管中)。
3、吹打完毕,将裂解产物全部转移至预冷的微量离心管中,置于冰上,每5min振荡一次,共孵育30min,以使其充分裂解。
4、4 ºC离心12,000g,离心时间为15 min。
5、每管各取10 µl上清液,进行蛋白定量(每个样品重复2孔)。
6、将各管上清液全部转移至新预冷的微量离心管中,记录各管的裂解总体积;以蛋白浓度最低的管为标准,用裂解液将其余各管调整至与该管相同的浓度;将各管样品与5×上样缓冲液混合后,于沸水中煮10min,即为蛋白样本;最终的样品于-80 ºC保存。
(二)组织裂解操作方法
1、用灭菌的预冷的工具分离目的组织,尽量置于冰上以防蛋白酶水解。
2、将组织块放在圆底的微量离心管或Eppendorf管中,加入液氮冻结组织于冰上均质研磨。
3、每约5 mg加入约300μl 预冷的裂解液,冰浴匀浆后置于4 ºC摇动2小时,裂解液体积与组织样本量有适当比例,(最终的蛋白浓度至少达到0.1mg/ml, 理想的蛋白浓度应为1-5 mg/ml)。
4、4 ºC离心12,000rpm,20 min,轻轻吸取上清,转移至新预冷的微量离心管中置于冰上,即为蛋白样本,弃沉淀。
(三)Westernblot 操作规程
1、封闭胶槽。灌胶之前,先用胶条封闭胶槽底部,再用5ml注射器将0.5%琼脂糖沿胶槽边沿快速(避免琼脂糖凝固)注入封闭胶槽。
2、配胶。浓缩胶的配制方案详见表1,分离胶的浓度选择详见表2,分离胶的配制方案详见表3。配胶时最后加TEMED。
表1.浓缩胶配制方案
表3. 分离胶的配制方案
3、分离胶的灌制。用注射器沿倒胶槽边缘迅速注入分离胶,每块胶按5ml配制即可。分离胶灌制完毕,于其上加入1ml去离子水,以防止胶面氧化。为使电泳槽两侧胶面的电泳速度一致,两侧胶槽内的分离胶及水的体积应保持一致。
3、浓缩胶的灌制。待分离胶凝固后(约50min),倒去胶面上层水,用滤纸吸干。沿胶槽边缘迅速注入浓缩胶,每块胶按4ml配制即可。然后,将梳子沿水平方向轻轻插入,防止气泡进入胶层。
4、蛋白样品准备。取出蛋白样品,于沸水中煮10min。煮好后瞬时离心,并置于37 ºC水浴箱中备用。
5、1×电泳缓冲液配制。去离子水400 ml,5×SDS电泳缓冲液100ml。
6、将浓缩胶放入电泳槽中(若只电泳一块胶,则胶槽另一侧需垫一块玻璃板),将电泳液缓慢注入电泳槽,槽内电泳液需漫过内侧的玻板,外侧需漫过金属线。加液完毕,轻轻拔掉胶条。
7.预电泳。在每块胶上任选择一电泳孔,加入20 μl左右上样缓冲液,在80V电压下进行电泳,直至上样缓冲液全部从分离胶中分离并进入电泳液中。
8、上样。待浓缩胶凝固后上样(约30min)。按照各管样品的总体积,算出其实际上样量(理论上样体积为30µl),加样前先用200µl加样器将样品轻轻混匀,上样速度要慢,否则样品易溢出加样孔。每加一个样品,进样针需用去离子水反复冲洗数次,再用电泳缓冲液润洗数次,以免交叉污染。蛋白Marker的上样量为4µl(不足30 µl时,以1×上样缓冲液补足)。上样完毕,在加样孔的两侧分别注入30µl1×上样缓冲液,以防止边缘效应。进样针用完后,先用去离子水清洗数次,再用甲醇反复冲洗,最后用去离子水清洗晾干后保存。
9、电泳。电泳采用恒压模式,先选择80V电压,待上样缓冲液运动至浓缩胶与分离胶分界线处时,将电压调整至100 V。待胶条中蛋白Marker的各条带彻底分离时,即可终止电泳。
10、切胶。电泳结束,取出胶槽中的玻璃板,根据目的蛋白大小,对比蛋白marker的相应位置,切下所需胶条,同时在靠近正常对照组一侧的左上角切一小块作为标志,然后将胶条置于1×电转液中。
11、电转前的准备:① 电转膜的准备。根据胶条的大小裁剪PVDF膜,并在膜的一角斜切以作为标志,然后将膜置于甲醇中浸泡2min后,迅速转移至电转液中,继续浸泡15 min(PVDF是疏水性的,在转膜缓冲液里很难浸透,甲醇处理后使更容易浸润。用甲醇泡的目的是为了活化PVDF膜上面的正电基团,使它更容易跟带负电的蛋白质结合)。②大蛋白(>100kD)易在凝胶里形成聚集沉淀,故转膜时在电转液中加入终浓度为0.1%的SDS,以避免出现这种情况;甲醇易使SDS从蛋白上脱失,故对大蛋白分子转膜处理时,应将电转液中甲醇的浓度降至10%,以防止蛋白沉淀。
12、滤纸的准备。根据所切胶条的大小裁剪滤纸(3张叠在一起),并将其浸于电转液中备用。所剪滤纸的长及宽均较PVDF膜小2mm,以防短路。
13、转胶。将夹子打开使黒的一面保持水平,其上垫一张海绵垫,用1ml枪头擀走里边的气泡;在海绵垫上垫三层滤纸,亦需擀走气泡;第3层放置胶条(胶条有切口的一侧位于左上角);第4层为膜(膜的切口与胶条的切口相对应),第5层为滤纸;第6层为海绵垫。电转液中含甲醇,操作时需带PE手套。
14、转膜。将夹子放入电转槽中,要使夹的黑面对槽的黑面,夹的白面对槽的红面。电转时会产热,应将电转槽放入盛有冰块的盆中。转膜时间视目标蛋白的分子量而定,恒流转膜(250mA),各目标蛋白的转膜时间如下:Bcl-2(28kD)、Bax(21kD)及Casepase-3(35/17/21kD)转膜时为50min;p38(38kD)、ERK(42/44kD)、SAPK(46/54kD)、β-actin(43kD)、及IκB(41kD)转膜时间为70min;Akt(60/56kD)转膜时间为90min;NF-κB(65kD)转膜时间为120min;PI-3(85kD)、VCAM-1(110kD)及ICAM-1(85-110kD)转膜时间为240min。
亦可进行半干转,条件如下:0.6 mA/cm2(Biorad公司电转仪),转膜时间视蛋白的分子量而定。
15、转膜完毕,回收电转液,将膜置于电转液中漂洗数分钟。
16、PBST配制。250μl Tween20加到500 ml PBS中即可。
17、① 5%脱脂奶粉配制:1.5g奶粉加30 ml PBST。②5%BSA配制:磷酸化蛋白应使用5%BSA封闭,因为脱脂奶粉含有酪蛋白,该蛋白本身就是一种磷酸化蛋白,此时使用脱脂奶粉会结合磷酸化抗体从而易产生高背景。
18、将膜置于5%的脱脂奶粉或BSA中,于摇床上封闭1h。封闭完毕,以PBST漂洗1次。
19、一抗的准备。将一抗贮存液按说明书提供的稀释倍数,用5%脱酯奶粉稀释成应用液。
20、一抗的孵育。一抗孵育可按以下两种方法进行:1)剪一PE指套;将PBST加入PE指套中,检查是否漏液;将膜加入指套中,再加入一抗,膜的正面朝下。2)取一培养皿,培养皿的底预先铺一层石蜡,培养皿的盖预先铺一张浸有去离子水的滤纸;将膜置于培养皿中,正面朝上,将抗体滴于其上(约1ml左右)。将加有一抗的膜在摇床上室温轻摇1 h,冰箱里4ºC封闭过夜。一抗的孵育时间取决于抗体与蛋白的亲和性及蛋白的含量丰度,建议使用较高的抗体稀释倍数和较长的孵育时间来保证特异性结合。尽可能选择低温孵育,如果在封闭液中孵育一抗过夜,应在4ºC进行,否则会产生污染而破坏蛋白(特别是磷酸基团)。
21、取出一抗,以PBST漂洗3次,每次5min。
22、按说明书提供的稀释倍数,用5%脱脂奶粉配制二抗。二抗孵育的滴加步骤亦与一抗相类;将加有二抗的膜室温下于摇床上轻摇1h,振摇时注意正面朝下。
23、取出二抗,以PBST于摇床上漂洗3次,每次5min。
24、化学发光反应。取出ECL发光试剂,吸取等体积的A液和B液配成反应液,充分混匀。将膜从PBST中取出并用滤纸吸干,放入已用石蜡填平的培养皿中,再加入配好的发光反应液,放入图像采集仪内成像,根据图像的亮度调整曝光时间。
附录3:细胞免疫组化操作规程
1、PBS洗细胞3次,每次5min.
2、4%多聚甲醛固定(以PBS溶解,溶解时需加热至60°C,同时加数滴1mol/l的NaOH),时间30min。
3、弃固定液,PBS洗3次,每次5min.
4、0.4%H2O2孵育10min(9.5ml甲醇+0.35 ml H2O2+0.15ml 30%H2O2),以抑制过氧化物酶。
5、弃上清,PBS洗3次,每次5min.
6、0.3%Triton(先配成3%的贮存液,临用时稀释。以PBS溶解,溶解时需加热至37°C),室温孵育25min。
7、弃上清,PBS洗3次,每次5min.
8、羊血清封闭10min.
9、弃血清,加一抗,4°C过夜。
10、次日,37°C 继续孵育1 h后,PBS洗2次,每次5min.
11、加二抗,37°C孵育1 h.
12、PBS洗2次,每次5min.
13、加DAB显色,至背景为浅黄色。
14、弃上清,PBS洗3次,每次5min.
15、苏木精染色5-10min.
16、弃苏木精,水洗数次。
17、饱和碳酸锂染30S.
18、弃碳酸锂,水洗数次。
19、盐酸酒精脱色,过一下即可。
20、弃上清,水洗数次。
21、微风吹干(一定要吹干,否则镜下非常模糊)。
22、梯度酒精透明,75%酒精30S;80%酒精30S;95%酒精1-2min;100%酒精2-3min.
23、二甲苯透明5-10min,充分风干。
24、10%磷酸甘油封片(甘油与PBS按1:9比例配制),镜检。
注:酸酒精:acid alcohol (0.5% concentrated HCl in 70%ethanol/water)